
1 2 3 4 5 6 7 8 9 10 11 12 13 [ 14 ] 15 16 17 18 19 20 21 22 23 24 25 26 27 28 29 30 31 32 33 34 35 36 37 38 39 40 41 42 43 44 45 46 47 48 49 50 51 52 53 54 55 56 57 58 59 60 61 62 63 64 65
Ш 2.3. КИНЕТИКА В РАСЧЕТАХ ХИМИЧЕСКИХ ПРОЦЕССОВ
2.3.1. Расчетные формулы
В химической технологии различают скорость превращения вещества и скорость реакции.
Скорость превращения вещества - количество /-го вещества, которое превращается в единицу времени в единице реакционного пространства:
... количествово превращенного /-го вещества
W:--.
единица времени х единицу реакционного пространства
Реакционное пространство - область протекания реакции (объем или поверхность). Если вещество образуется, то W- > О, если расходуется, IV. < 0.
Так как количества веществ, участвующих в реакции, связаны между собой стехиометрическими соотношениями, то скорости их превращения находятся в зависимости
а/а = b/Vb = r/vr = = const = г.
Здесь знак v. определен в соответствии с алгебраической формой записи химического уравнения (2.3).
Величину г определим как скорость химической реакции. Она равна абсолютному значению скорости превращения вещества, у которого стехиометрический коэффициент v, = 1.
Скорость превращения /-го вещества в сложной реакции
где Г- - скоростьу-й частной реакции.
Кинетическое уравнение - функциональная зависимость скорости реакции или скорости превращения вещества от условий ее протекания (концентрации реагентов, температуры, давления):
г=г{Т,С) = кШС),
где к - константа скорости реакции, зависящая только от температуры. Зависимость к(Т) определяется уравнением Аррениуса
к = к^ехр[-Е/{КТ)].
Размерность к определяется видом функциональной зависимости 7(0 и размерностью г.
Вид зависимости ДО определяется типом и механизмом реакции. ЕслиДО представлена степенной функцией, т е./О = С , то величину п называют порядком реакции. Его обычно определяют эксперимен-
тально, поэтому он может не совпадать со стехиометрическим коэффициентом.
Скорость обратимой реакции vA + VgB <=> vR + VgS записывается в виде разности скоростей прямой г^ и обратной г^ реакций:
V - обр = ЧШС) - li-iimiQ = A:,(7)/i(C)[l - Ц){С)/К^],
где Кр = ki/k ; ф(с) = Cffi/iC.
Для сложных реакций вводится дифференциальная селективность по продукту (S) - отношение скорости превращения исходного вещества в заданный продукт к общей скорости превращения исходного вещества:
где д=к - скорость превращения исходного вещества А в продукт R; - общая скорость превращения исходного вещества А.
Для простой реакции 6 = 5 = 1.
Развитие реакций во времени описывается уравнением
dC./d?= fV-iQ. (2.21)
Простая необратимая реакция первого порядка, т.е. г (С) = кС, dC/dt = -кС или dx/dt = г{1 - х). После интегрирования получим
х= 1 -е-.
Для обратимой реакции первого порядка А <=> R скорость реакции /-= А:Сд- А: [С^ и dx/d= А:(1 -х) - к уХ= к^ - (А:, + А; ,)х
Изменение степени превращения во времени
х = --e-(*i + *-i).
Параллельная реакция:
kj S
Изменение концентраций:
dCA/dr= -{ki + )Сд; dC/dt= куС^, dCdtkC. После интегрирования получим:
Последовательная реакция:
А-L R-i-S.
Изменение концентраций:
d Сд/dr = -A:i Сд; d C/d/ = Сд - С^; d C/d/ = /tj Cr. После интегрирования получим:
Сд=Сое-*1; (2.22а)
Cr = Со[е-1 - е-*2Т ; (2.226)
С8=Со-Сд-Ск. (2.22В)
Максимальная концентрация целевого продукта R будет достигнута при условии АС1дЛ = 0. Используя решение (2.226), получим координаты точки максимума:
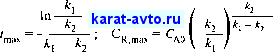
(2.23)
2.Z.2. Примеры расчета
Пример 2.3-1. Протекает газофазная обратимая реакция А <=> R. В исходном состоянии компонент R отсутствует, а парциальное давление компонента А равно 1,275-10 * Па. Через 10 мин парциальное давление компонента А стало 5,210 Па, а компонента R - 7,5510 Па. Рассчитать значение парциального давления компонента А через 20 и 40 мин, если отношение k/k = 3.
Сд = Сое-(*1 + 2); С^ = с,{\ - е-(*. - Щ.